镁质耐火材料与钢中镁铝尖晶石夹杂形成的热力学关系
- 发布人:管理员
- 发布时间:2013-09-05
- 浏览量:605
魏耀武1,李 楠1, 潘德福2
(1. 武汉科技大学耐火材料与高温陶瓷湖北省重点实验室, 武汉 430081; 2. 中材人工晶体研究院, 北京 100018)
摘要: 洁净钢用耐火材料已越来越受到人们的关注, 耐火材料是钢中氧化物夹杂的主要来源之一。为了考察耐火材料对钢中氧含量的影响, 将纯铁置于镁质浇注料坩埚中在还原气氛下于 1600C温度保温3h。对试验后的钢样进行了SEM 和EDS 分析,结果发现钢中有 MgO·Al2O3 夹杂形成。本文从热力学的角度对试验过程中熔钢里形成的尖晶石氧化物的成因进行了分析,计算结果表明: 即使钢中的 Al 含量较低, MgO·Al2O3 尖晶石依然可以形成。
关键词: 镁质耐火材料;热力学;尖晶石夹杂
随着洁净钢需求的日益增加, 钢厂对耐火材料的选择越来越严格。这就促进材料工作者对耐火材料与熔钢之间的反应进行研究 [1]。理查森-杰佛斯图 [2]对耐火材料的氧潜能提供了初步的参考数据, 它可以认为是选择某些洁净钢用耐火材料的指南, 尤其是那些对氧含量比较敏感的特殊钢种。而碱性耐火材料被认为是一个合适的选择。我们已经在耐火材料与熔钢之间的反应这一研究领域做了大量的工作, 其中耐火材料对钢中总氧含量的影响是研究的一个重要内容 [3 ~ 6]。研究中发现: 在冶炼后的钢样中有 MgO·Al2O3 杂质的存在。本文通过热力学计算来分析以镁质耐火材料为内衬进行冶炼的钢中 MgO·Al2O3 杂质的形成原因。
1 试验过程
以 SiO2 微粉为结合剂,大结晶电熔镁砂为颗粒料和粉料,制得镁质坩埚(外层为石墨坩埚),如图 1 所示。坩埚自然养护24h后,在110℃温度下干燥24h,再将盛有纯铁的试验坩埚装入匣钵中,四周用焦炭填充密实后送入试验炉内,从室温开始升温到1600℃,并保温3h。然后自然冷却至室温,出炉。对试验后的钢样进行 SEM 和 EDS 分析。
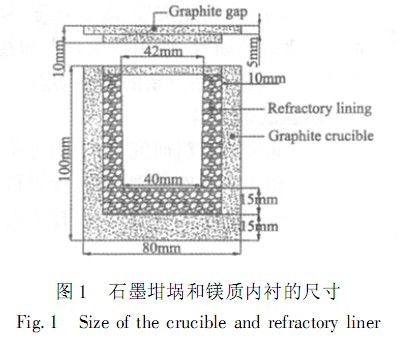
试验用原料的化学组成如表1 所示。纯铁的杂质组成(ω/ %)如下: C (0.019)、 Si (0.12)、 Mn (0.13)、P (0.0067)、 S (0.0014)、 Al (0.2)、 Cr (0.015)。

2 结果与讨论
通过 SEM 和 EDS 分析,发现钢样中有镁铝尖晶石夹杂存在,夹杂物近似球形,尺寸在5 m 左右,如图2所示。由于试验用纯铁中的 Mg 含量极低,所以钢样中的 MgO 只有可能来自耐火材料。

2.1体系中(1873K ),CO的分压
研究体系中,碳是过剩的,此时体系中存在的气体有: CO、 CO2 和 N2。此时体系中气体的组成[7]:
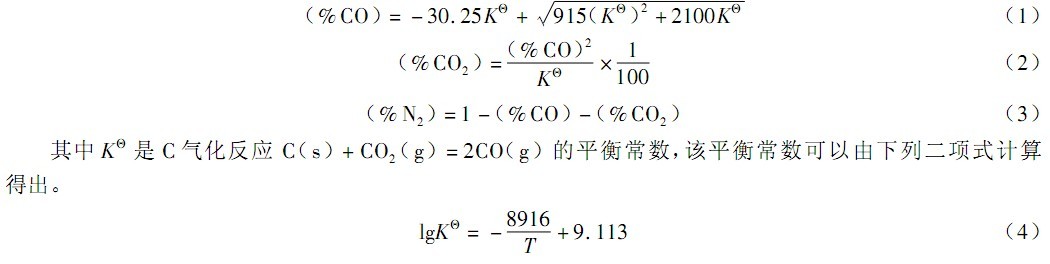
1873K 时,KΘ = 22528, 于是可以计算出各气相的组成。
(%CO)= 11. 4; (%CO2)= 0. 00006, %CO2 数值极小, 可以忽略不计, 所以, (%N2)= 88. 6。
计算可知体系中 CO 和 N2 的摩尔分数分别为:nN2= 11. 4;nCO = 88. 6 体系中,PCO +P N2= 0. 1Mpa 可得:PCO = 0. 0114Mpa。
2.2熔钢中氧含量的确定
熔钢中氧含量的计算有两种途径。
一是,根据1873K 温度下的[C]和[O]之间的平衡关系式(2),可以计算出熔融钢液中的起始O含量。
[%O]·[%C]= 0. 0025PCO(5) [8]
式中[%C] 是熔钢的起始C 含量(纯铁熔化时的状态),[%C]= 0. 019。于是可以得出纯铁熔化时其中氧的起始含量:[%O]= 0. 0015。
二是,由于耐火材料中含有 SiO2,由其产生的[O] 必须考虑,
SiO2(S)=[Si]1% + 2[O]1% (6)
△G0(6)= 580550 - 220. 66 T[7]
T= 1873K 时,α[Si]α2[O]= 2. 16× 10- 5, 钢中的起始 [%Si]= 0. 12。于是又可以得到 [%O]= 0. 0134。
显然,由于耐火材料中 SiO2 的存在,熔钢中的氧含量已达到了一个较高的值, 此时, 熔钢中的平衡氧含量应该为0. 0134%。
2.3钢中 [Mg] 的来源
根据元素的活动性排序,金属Al 排在金属 Mg 之后,也就是说, 钢液中的 Al 是不能将耐火材料中的MgO 还原成金属 Mg 的。钢液中的 Mg 可能来源于以下两个反应:

从反应(7)至(9)的热力学关系可以得到反应:
MgO(s)=[Mg]1% +[O] 1% (10)
反应(10)的标准吉布斯自由能变化为:△G0(10)= 484720-147. 41T ,同时,△G0(10)= -RT lnα[Mg]·α[O],温度为1873K 时,α[Mg]·α[O]= 1. 52 > 10 - 6,α[Mg]和α[O]分别是熔钢中Mg 和 O 的活度。由于钢液中的[%Mg]和[%O]含量极低,取符合亨利定律的1%稀溶液为标准状态时,可以用相应物质的浓度代替。α[O]0. 0134,可以得到α[Mg]= 0. 0001, 即, 熔钢中[%Mg]= 0. 0001。
二是,反应: MgO(S)+ C(s)= Mg(g)+ CO(g)(11)
△G0(11)= 613165 - 289. 74T
由上式可以计算出1873K 时,△G0(11)> 0, 即氧化镁和石墨在1873K 时是不会发生反应的。
从上面的分析中可以看出, 钢中镁的来源是高温下氧化镁颗粒的分解后其中的镁蒸汽溶于钢所致。
2.4钢中MgO·Al2 O3夹杂的形成
钢液中 MgO·Al2 O3 夹杂的形成有两个途径:
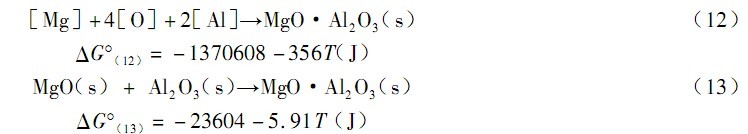
由于钢液中[%Mg]、[%O]和 [%Al] 的浓度均很低,取符合亨利定律的1%稀溶液为标准状态,可以用各自相应的浓度值来替代相应的活度。即α[AI]= 0. 2,α[Mg]= 0. 0001,α[O]= 0. 0134, 于是可得:
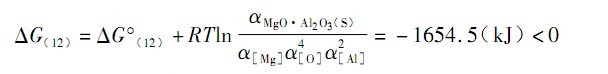
这就意味着反应 (10) 可以在1873K 下发生。
在上述反应中形成的镁铝尖晶石是非化学计量的(从图 2 的 EDS 分析可以看出) , 而且, 即使钢中的[Al] 含量只有0. 02% (质量分数),该值低于实际铝镇静钢中的 [Al] 含量,但是计算出反应(12)的△G(12)仍然 < 0(为 - 1590. 6kJ)。这就说明,尖晶石夹杂的形成是比较容易的。
反应(12)已被证明是可以在1873K 时生成的, 它是合成尖晶石原料的基本原理。如果需要计算,也可以发现:△G(13)= △G0(13)< 0。
从以上的分析可以看出:即便耐火材料中的氧化镁颗粒不向钢中溶解,由于其在高温下的分解, 也会造成钢液中尖晶石夹杂的形成。由于夹杂物的尺寸较小,不易由钢液中排除, 这将影响到钢的总氧含量值。降低这一不利影响的手段有:一是采用有效的去除夹杂的手段, 促使钢中夹杂物的上浮; 二是选择不易在高温下挥发或挥发程度较低的物质, 如氧化钙或合成镁钙砂作为炉衬的主要原料。同时,也可以看出,由于耐火材料中使用了氧化硅微粉作结合剂,由此也使的钢液中的氧含量大大增加,这也会增加钢的总氧含量值, 对钢材质量不利。但是这对尖晶石夹杂的形成影响并不大,我们作过计算,即使不采用氧化硅微粉作结合剂,G(12)的值依然可以达到 - 1664. 6 (kJ)< 0,此时,α[Mg]= 0. 001,α[O]= 0. 0015。
3 结论
即使钢液中的[l]含量较低, 采用镁砂为主要原料作炉衬时,由于 MgO 在高温下会分解产生Mg气体,Mg(g)熔入钢中后,导致 MgO·Al2O3夹杂可以在钢液中形成,同时二氧化硅微粉的使用会增加熔钢的氧含量。

【中国镁质材料网 采编:ZY】




